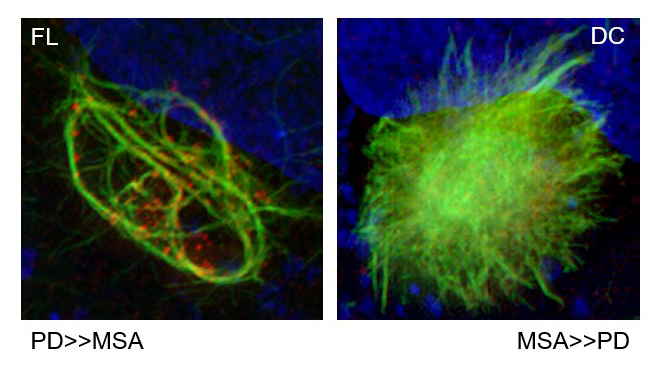
Images microscopiques en haute résolution de cultures cellulaires où l'alpha-synucléine (en vert) présente une structure filamenteuse (à gauche), plus susceptible de mener à la maladie de Parkinson, ou une structure à noyau dense (à droite), plus susceptible de mener à une atrophie multi-systématisée.
Une équipe internationale composée de chercheurs japonais et luxembourgeois montre pour la première fois que les formes pathologiques de la protéine alpha-synucléine présentes dans le sang des patients peuvent servir au diagnostic de la maladie de Parkinson. Elles permettent également de distinguer plusieurs troubles neurodégénératifs moteurs entre eux.
Ces résultats inédits, récemment publiés dans Nature Medicine, constituent une avancée importante vers la mise au point d’un test diagnostic basé sur une simple prise de sang.
La maladie de Parkinson, la démence à corps de Lewy et l'atrophie multi-systématisée constituent un groupe de maladies neurodégénératives appelés synucléinopathies. Elles sont causées par l'agrégation anormale de la protéine α-synucléine. Ces agrégats apparaissent progressivement dans le cerveau des patients et provoquent la mort des cellules nerveuses, entraînant différents symptômes neurologiques, des tremblements à la démence, en fonction de la zone du cerveau touchée. Il n'existe actuellement aucun traitement curatif pour ce groupe de maladies et le diagnostic est souvent le résultat d’un long processus impliquant des examens cliniques et d'imagerie médicale. De plus, distinguer ces troubles entre eux à un stade précoce reste un défi.
Des études antérieures ayant révélé que l'α-synucléine s'accumule non seulement dans le cerveau mais aussi dans les nerfs périphériques, des chercheurs de l'Université de Juntendo, du RIKEN Centre for Brain Science et de l'Université de Nagasaki ont émis l'hypothèse que des fibrilles d'α-synucléine, baptisées « α-synuclein seeds » en anglais, pourraient également être présentes dans le sang des patients. Ces formes pathologiques de la protéine, qui peuvent induire un changement dans la structure des molécules d'α-synucléine normales et provoquer leur agrégation, circuleraient dans le système vasculaire et contribueraient ainsi à la progression de la maladie.
« L’idée est qu'un biomarqueur véhiculé par le sang pourrait refléter la propagation de la maladie, » explique le professeur Nobutaka Hattori, du département de neurologie de l’Université de Juntendo et actuel directeur du Neurodegenerative Disorders Collaboration Laboratory au RIKEN Centre for Brain Science. « C'est pourquoi nous avons développé une nouvelle méthode pour détecter de très petites quantités d'α‑synucléine dans le sérum sanguin et nous avons ensuite réalisé un dépistage à grande échelle chez des patients atteints de différentes synucléinopathies. » La méthode, appelée IP/RT‑QuIC, repose sur l'immunoprécipitation (IP) pour concentrer les protéines mal repliées dans le sérum des patients et sur la conversion en temps réel (RT-QuIC) pour amplifier ces fibrilles d'α-synucléine.
Les chercheurs japonais ont fait équipe avec des scientifiques du Luxembourg Centre for Systems Biomedicine (LCSB) de l'Université du Luxembourg, du Luxembourg Institute of Health (LIH) et du Laboratoire National de Santé (LNS), bénéficiant ainsi de données cliniques et neuropathologiques collectées au cours de la dernière décennie au Luxembourg. Cette base de données établie dans le cadre du Centre national d'excellence pour la recherche sur la maladie de Parkinson (NCER-PD) est unique. « Nous suivons plus de 900 personnes ayant la maladie de Parkinson et d'autres formes de parkinsonisme depuis neuf ans. Grâce à des visites annuelles, nous pouvons retracer l’évolution clinique de ces patients. Nous avons de plus collecté des échantillons de sang et de liquide céphalo-rachidien, ainsi que de tissu cérébral lors d’autopsies, » détaille le professeur Rejko Krüger, directeur du département Transversal Translational Medicine au LIH et responsable de l’équipe Translational Neuroscience au LCSB. « Le design de l’étude nous permet de comparer les différentes synucléinopathies et de les différentier d’autres maladies neurodégénératives. » Le professeur Michel Mittelbronn, directeur du Luxembourg National Centre of Pathology, ajoute : « Nous avons également créé une banque de cerveaux au Luxembourg, ce qui nous donne accès aux cerveaux légués par certains patients pour des analyses post-mortem. Cela fournit des données neuropathologiques complémentaires, la référence pour le diagnostic des maladies neurodégénératives, qui permettent de valider les observations cliniques. »
Cette collaboration s'est avérée fructueuse : la méthode IP/RT-QuIC a permis de détecter des fibrilles d'α-synucléine dans le sérum de 95 % des patients atteints de synucléinopathies. Elle a également montré que la structure de ces fibrilles diffère d'une maladie à l'autre. En outre, lorsque les chercheurs ont testé le comportement de ces fibrilles dans des modèles in vitro et in vivo de la maladie de Parkinson, leur propagation et leur agrégation ont suivi le même schéma que celui observé chez les patients. « Nous avons non seulement réussi à détecter des fibrilles d'α-synucléine dans le sérum de patients atteints de la maladie de Parkinson et d'autres troubles neurodégénératifs, » se réjouit le professeur Hattori. « Mais notre équipe a également découvert, pour la première fois, que ces fibrilles ont des structures et des propriétés propres à chaque synucléinopathie, ce qui suggère qu'elles façonnent chaque pathologie. »

De gauche à droite: le Prof. Rejko Krüger et le Prof. Nobutaka Hattori
En conclusion, les fibrilles d'α-synucléine sont des marqueurs utiles pour le diagnostic de la maladie de Parkinson et permettent de distinguer plusieurs troubles neurodégénératifs entre eux. Ces résultats vont changer la donne pour les synucléinopathies, avec notamment la mise au point d’un test diagnostic basé sur la présence et la forme des fibrilles dans le sérum. « Pouvoir diagnostiquer la maladie de Parkinson à l'aide d'une simple prise de sang constituera un progrès majeur car actuellement cela repose en grande partie sur un examen clinique effectué par un neurologue, » souligne le professeur Krüger. « Nous sommes très fiers de contribuer à ces travaux de recherche grâce à NCER-PD. Cela illustre l'importance du suivi à long terme de larges cohortes de patients. C’est en collectant ainsi des données exhaustives que nous pourrons de mieux en mieux répondre aux besoins des personnes atteintes de la maladie de Parkinson. »
Référence : Ayami Okuzumi, Taku Hatano, Gen Matsumoto, Shuko Nojiri, Shin-ich Ueno, Yoko Imamichi1, Haruka Kimura, Soichiro Kakuta, Akihide Kondo, Takeshi Fukuhara, Yuanzhe Li, Manabu Funayama, Shinji Saiki, Daisuke Taniguchi, Taiji Tsunemi, Deborah McIntyre, Jean-Jacques Gérardy, Michel Mittelbronn, Rejko Krüger, Yasuo Uchiyama, Nobuyuki Nukina & Nobutaka Hattori, Propagative α-synuclein seeds in the serum of patients with synucleinopathies, Nature Medicine, May 2023.
© Ayami Okuzumi
© Université du Luxembourg
En conclusion, les fibrilles d'α-synucléine sont des marqueurs utiles pour le diagnostic de la maladie de Parkinson et permettent de distinguer plusieurs troubles neurodégénératifs entre eux. Ces résultats vont changer la donne pour les synucléinopathies, avec notamment la mise au point d’un test diagnostic basé sur la présence et la forme des fibrilles dans le sérum. « Pouvoir diagnostiquer la maladie de Parkinson à l'aide d'une simple prise de sang constituera un progrès majeur car actuellement cela repose en grande partie sur un examen clinique effectué par un neurologue, » souligne le professeur Krüger. « Nous sommes très fiers de contribuer à ces travaux de recherche grâce à NCER-PD. Cela illustre l'importance du suivi à long terme de larges cohortes de patients. C’est en collectant ainsi des données exhaustives que nous pourrons de mieux en mieux répondre aux besoins des personnes atteintes de la maladie de Parkinson. »
Référence : Ayami Okuzumi, Taku Hatano, Gen Matsumoto, Shuko Nojiri, Shin-ich Ueno, Yoko Imamichi1, Haruka Kimura, Soichiro Kakuta, Akihide Kondo, Takeshi Fukuhara, Yuanzhe Li, Manabu Funayama, Shinji Saiki, Daisuke Taniguchi, Taiji Tsunemi, Deborah McIntyre, Jean-Jacques Gérardy, Michel Mittelbronn, Rejko Krüger, Yasuo Uchiyama, Nobuyuki Nukina & Nobutaka Hattori, Propagative α-synuclein seeds in the serum of patients with synucleinopathies, Nature Medicine, May 2023.




